IPP Empfehlung: Inhalt einer Technischen Dokumentation nach MDR, Anhang II & III
Die Technische Dokumentation, Technical File, Produktakte oder auch einfach nur TecDoc ist das zentrale Nachweisdokument beim Konformitätsbewertungsverfahren zur CE-Kennzeichnung für Medizinprodukte.
Aber was sollte alles in einer Technischen Dokumentation enthalten sein?
In den Anhängen II und III der MDR wird erläutert, was die Technische Dokumentation mindestens beinhalten soll. In Anhang II wird hierbei auf das Produkt selbst eingegangen sowie Anhang III legt die Anforderungen an die Marktüberwachung nach dem Inverkehrbringen (Post-Market Surveillance) mit Planung und Durchführung fest.
Die MDR fordert in Anhang II mindestens:
- PRODUKTBESCHREIBUNG UND SPEZIFIKATION, EINSCHLIESSLICH DER VARIANTEN UND ZUBEHÖRTEILE
- Produktbeschreibung und Spezifikation (z.B. UDI, Intended Use)
- Hinweis auf frühere und ähnliche Generationen des Produkts
- VOM HERSTELLER ZU LIEFERNDE INFORMATIONEN (z.B. Labels, GBAs/IFU)
- INFORMATIONEN ZU AUSLEGUNG UND HERSTELLUNG
- GRUNDLEGENDE SICHERHEITS- UND LEISTUNGSANFORDERUNGEN
- NUTZEN-RISIKO-ANALYSE UND RISIKOMANAGEMENT
- VERIFIZIERUNG UND VALIDIERUNG DES PRODUKTS
- Vorklinische* und klinische Daten
- In besonderen Fällen erforderliche zusätzliche Informationen
* mit vorklinischen Daten sind z.B. „technische Tests, Labor- , Anwendungssimulationstests o.ä.“ gemeint. Sie müssen nicht, wie es der Begriff vermuten lässt, unbedingt klinischen Hintergrund haben, sondern die Sicherheit des Produkts und seiner Konformität mit den Spezifikationen widerspiegeln.
IPP Tipp hierzu:
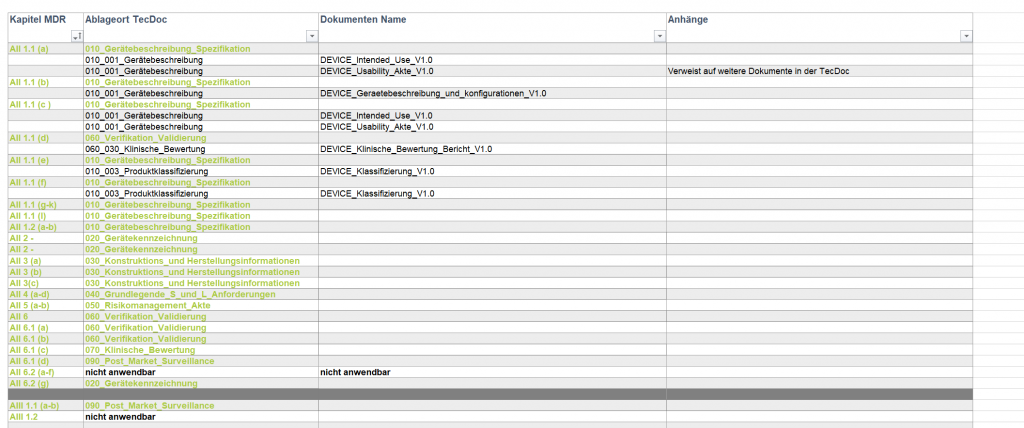
Wichtig bei der Zusammenstellung der Technischen Dokumentation ist, dass sie in „klarer, organisierter, leicht durchsuchbarer und eindeutiger Form“ vorliegt. Hierzu empfiehlt sich eine Art Inhaltsverzeichnis als extra Dokument für die Benannte Stelle (BS) zu erstellen. Dieses übergeordnete Dokument geht auf die Kapitel der Anhänge II & III ein und verweist, welche Dokumente die entsprechenden Kapitel abdecken sowie, wo sie in der TecDoc zu finden sind. So kann sich der Prüfer der BS schnell einen Überblick verschaffen und ihm wird die Arbeit erleichtert, was zu einem schnelleren Abarbeiten Ihrer Dokumentation führen kann.
Folgendes Beispiel zeigt, wie ein solches Inhaltsverzeichnis-Dokument aussehen kann:
Benötigen Sie weitere Hilfe bei der Erstellung, Anpassung oder Umstellung der Technischen Dokumentation? Reichen Ihre eigenen Ressourcen nicht mehr aus?
Unsere fachkompetenten Experten helfen Ihnen schnell sowie effizient in allen Bereichen der Technischen Dokumentation.
» Sprechen Sie uns an, wir erarbeiten Ihnen Ihr individuelles Angebot!
