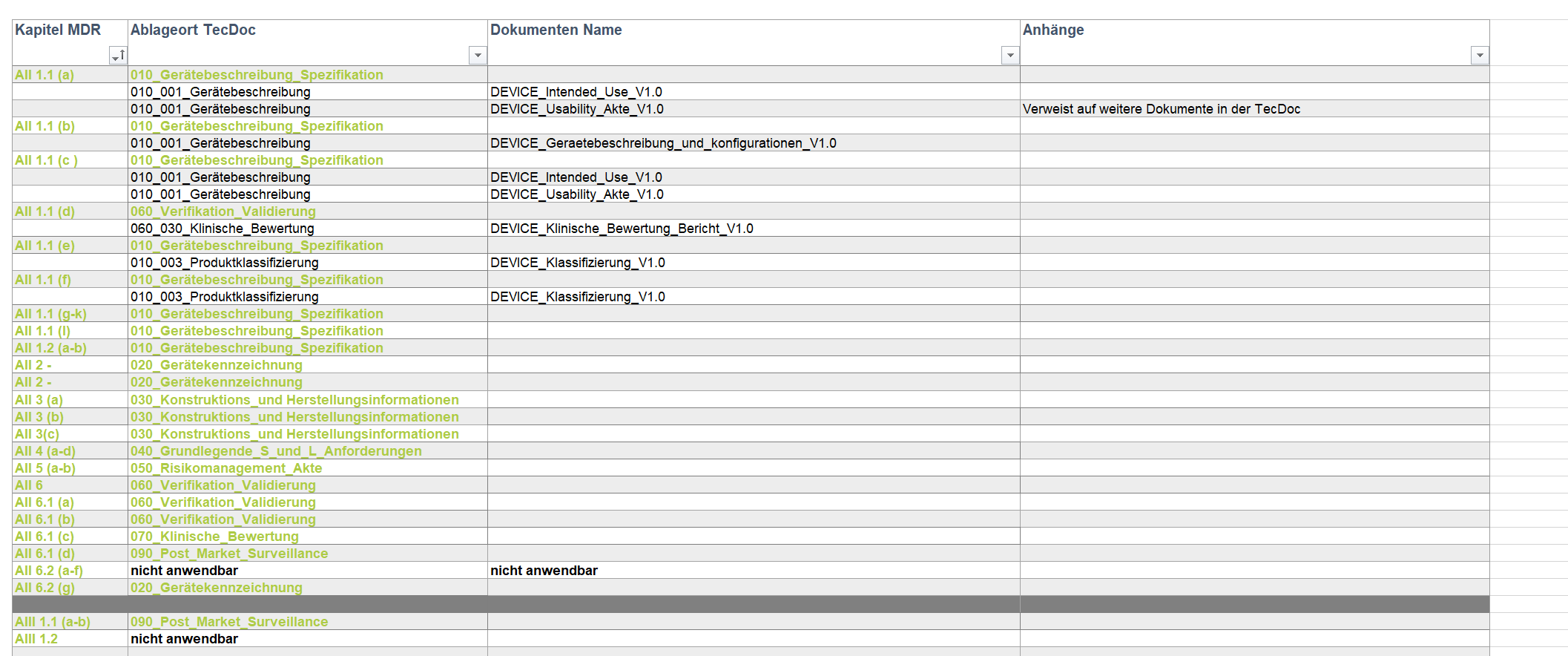
Technische Dokumentation
Sie benötigen für Ihr Medizinprodukt eine Technische Dokumentation nach MDR 2017/745?
Wir kennen das Problem und haben genau die richtige Lösung für Sie. Dank unseren flexiblen sowie vielseitigen Leistungspaketen erhalten Sie eine strukturierte Technische Dokumentation nach MDR.

Erfahrung
Unter Berücksichtigung der Anforderungen erstellen wir eine systematische sowie strukturierte Technische Dokumentation nach MDR.
Flexibilität
Des Weiteren können Sie nach Ihren Bedürfnissen aus unseren flexiblen Leistungspaketen wählen.
Produktakte nach MDR
Weiterhin helfen wir Ihnen bei der Umstellung der Produktakte auf die neue Medizinprodukte Verordnung (MDR).

Bürokratie minimieren
Außerdem minimieren wir für Sie die Bürokratie. Darüber hinaus halten wir Ihnen den Rücken frei und Sie können sich vollständig auf Ihr Medizinprodukt konzentrieren.
Grundlagen
Die Technische Dokumentation ist ein wesentlicher Bestandteil des Konformitätsbewertungsverfahrens im Rahmen des CE -Kennzeichnungsprozesses. Sie ist für den Hersteller das zentrale Nachweisdokument zur Erfüllung der grundlegenden Sicherheits – und Leistungsanforderungen sowie Grundlage für die Prüfung durch benannte Stellen. Außerdem muss die Technische Dokumentation nach der MDR 2017/745 erfolgen.
Technische Dokumentation nach MDR
Sie benötigen Unterstützung bei dem rechtsicheren Inverkehrbringen Ihres Medizinproduktes? Und wollen des Weiteren die Produktakte auf die neu Medizinprodukt Verordnung 2017/745 umstellen?
Als externer Experte übernimmt IPP die Planung sowie Umsetzung für Ihr Projekt. Außerdem steht wir Ihnen mit der nötigen Fachkompetenz zur Seite.

FAQ
Most frequent questions and answers
- Als externer Experte übernimmt IPP sowohl die komplette Planung als auch die Umsetzung für Ihr Projekt.
- Mit einem fundierten Wissen sorgt unser Team des Weiteren für einen erfolgreichen Ablauf.
- Darüber hinaus sorgen wir für einen systematischen und strukturierten Aufbau der Technischen Dokumentation für Ihr Medizinprodukt
-
Hierbei werden die europäischen Anforderungen sowie Regelwerke berücksichtigt
- Außerdem erfolgt ein sicheres Inverkehrbringen Ihres Medizinproduktes
- Weiterhin können wir hilfreich bei dem CE -Kennzeichnungsprozess zur Seite stehen
- Aktualisierung der Produktakte über den gesamten Produktlebenszyklus
- Des Weiteren sorgen wir für eine flexible Abarbeitung nach Ihrem Bedarf
- Die Termine sowie die Kosten haben Sie im Griff
- Außerdem arbeiten Sie mit erfahrenen Projektmanagement – Spezialisten zusammen
-
Wir helfen Ihnen beim Schreiben sowie Prüfen der technischen Dokumentation
- Darüber hinaus entscheiden Sie selbst, inwieweit sich sich mit einbringen wollen
- Wir sind up to date in allen relevanten Normen sowie Richtlinien
- Sie sind weiterhin flexibel, denn je nach Situation können Sie auf ein Expertenteam zurückgreifen
Sie entscheiden ganz flexibel sowie je nach Situation, wie viel Sie sich selbst als Unternehmen einbringen. Neben dem Bereich Beratung zur Technischen Dokumentation können wir außerdem noch viele weiteren Leistungen anbieten. Unser Team führt Sie somit sicher durch den Dschungel der Regularien.
Die Hersteller von Medizinprodukten sind verpflichtet sich an die MDR zu halten.
Die Technische Dokumentation ist für den Hersteller das zentrale Nachweisdokument zur Erfüllung der grundlegenden Sicherheits – sowie Leistungsanforderungen.
MDR
Hierbei handelt es sich um die Medical Device Regulation / Medizinprodukt Verordnung 2017/745 der EU, an die sich die Hersteller von Medizinprodukten halten müssen.

Wie wir helfen können
Wir sondieren gemeinsam das Problem und erstellen anschließend einen Plan.
Telefonische Bürozeiten
Montag bis Freitag
8:00 - 14:00 Uhr
8:00 - 14:00 Uhr