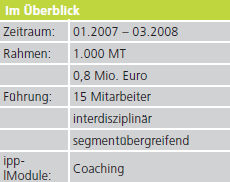
IPP Notizen aus der Praxis
Ausgangslage:
Der Kunde ist Hersteller von individuell konfigurierbaren Behandlungseinheiten. Für jede Behandlungseinheit wurde eine Konformitätserklärung nach MDD (Medical Device Directive) erstellt. Dadurch war der Dokumentationsaufwand für das Klasse IIa Produkt sehr hoch, was für das mittelständische Unternehmen mit einer kleinen QM-/RA-Abteilung (Qualitätsmanagement-/ Regulatory Affairs-Abteilung) und mit wachsenden Anforderungen nicht mehr zu stemmen war.
Zudem stand die Umstellung der Technischen Dokumentation (TecDoc) auf die MDR (Medical Device Regulation) an.
Zu diesem Zeitpunkt war im QMS (Qualitätsmanagementsystem) des Herstellers die Entwicklung nach 7.3. der ISO 13485 unter MDD ausgeschlossen. Die ISO 13485 lässt zwar weitreichende Ausschlüsse und Einschränkungen zu, die aber mit den Anforderungen unter der MDR bei der Benannten Stelle (BS, in diesem Fall TÜV Süd) nicht mehr gern gesehen werden und nach „Empfehlung“ der BS in das QMS integriert werden.
Projektziel:
- Umstrukturierung / „Vereinfachung“ der TecDoc, um den Dokumentationsaufwand effizienter zu gestalten
- Gleichzeitige Umstellung der Klasse IIa TecDoc, um die Anforderungen der MDR zu erfüllen
- Integration der Entwicklung nach 7.3. der ISO 13485 in das QMS und in die TecDoc der Produktfamilien
Idee/ Umsetzung
- Die Komponenten / Bestandteile, aus der eine Behandlungseinheit besteht, in einzelne Produktfamilien aufteilen.
- Bildung von Produktfamilien („Gruppe von Produkten mit gleichen oder ähnlichen Zweckbestimmungen oder mit technologischen Gemeinsamkeiten, die allgemein, also ohne Berücksichtigung spezifischer Merkmale klassifiziert werden können“, MDR Artikel 2(7))
- Erstellung einer eigenen TecDoc für jede Produktfamilie (Klasse I und Klasse IIa Produkte)
- Die Kombination der Komponenten aus einer Produktfamilie zu einer Behandlungseinheit als „System*“ deklarieren.
- „System“ bezeichnet eine Kombination von Produkten, die zusammen verpackt sind oder auch nicht und die dazu bestimmt sind, verbunden oder kombiniert zu werden, um einen spezifischen medizinischen Zweck zu erfüllen. MDR Artikel 22
- Die TecDoc einer Produktfamilie (Klasse IIa) der Behandlungseinheit sollte als Pilotprojekt bei der BS eingereicht werden. Im Anschluss werden die Anmerkungen der BS in die weiteren TecDoc der Klasse IIa Produkte eingearbeitet und auch eingereicht.
*Im allgemeinen zahnmedizinischen Sprachgebrauch wird das “regulatorische System” oft als “Behandlungseinheit” bezeichnet.
Durchführung der Unterstützung bei der Umstellung der TecDoc auf MDR
GAP-Analyse
Eine GAP-Analyse durch IPP ergab Arbeitspakete und eine individuelle Checkliste für den Kunden, die durch den Kunden eigenständig und/oder mit der Unterstützung von IPP abgearbeitet werden konnte.
Außerdem ist eine weitere Checkliste mit den Anforderungen der Benannten Stelle in die Arbeitspakete mit eingeflossen.
Anpassung bestehender und Erstellung neuer MDR Dokumente
Durch die verschärften Anforderungen der MDR mussten 90 % der Dokumente der TecDoc angepasst werden. Wichtig hierbei ist vor allem die Rückverfolgbarkeit (Traceability), also die Nachvollziehbarkeit von Anforderungen (Stakeholder / Product Requirements) über Umsetzung (Design) bis hin zum Nachweis der Umsetzung (Reporting der Verifizierung und Validierung).
Somit war IPP in diesem Zusammenhang federführend bei der Erstellung und Dokumentation des Design In- /Outputs, der Risikoanalysen und der Nachweise der V&V- (Verifizierung und Validierung) und PMS- (Post-Market Surveillance) Aktivitäten.
Zudem ist IPP als externer Dienstleister weiterhin mit die klinischen Bewertung beauftragt.
Außerdem wird die Erstellung und Bearbeitung von der begleitenden Dokumentation (Gebrauchsanweisung bzw. IFU (Instruction for Use)) durchgeführt.
Unterstützung von Verifizierungs- und Validierungsaktivitäten intern und bei externen Prüflaboren
Einschlägige Normen für Behandlungseinheiten, um die grundlegenden Sicherheits- und Leistungsanforderungen nachzuweisen, sind u.a.:
- DIN EN ISO 7494-1:2018-10
Zahnheilkunde – Fest installierte dentale Behandlungseinheiten und dentale Patientenliegen – Teil 1: Allgemeine Anforderungen
- DIN EN ISO 7494-2:2023-03
Zahnheilkunde – Fest installierte dentale Behandlungseinheiten und dentale Patientenliegen – Teil 2: Luft-, Wasser-, Absaug- und Abwassersysteme
- ISO 17664-2:2021-02:
Aufbereitung von Produkten für die Gesundheitsfürsorge – Vom Medizinprodukt-Hersteller bereitzustellende Informationen für die Aufbereitung von Medizinprodukten – Teil 2: Nicht-kritische Medizinprodukte
- DIN EN ISO 21530:2004-09:
Zahnheilkunde – Materialien für Oberflächen von zahnärztlichen Ausrüstungen – Bestimmung der Beständigkeit gegen chemische Desinfektionsmittel
- DIN EN ISO 10993-1:2021-05:
Biologische Beurteilung von Medizinprodukten – Teil 1: Beurteilung und Prüfungen im Rahmen eines Risikomanagementsystems
- DIN EN ISO 16954:2015-11:
Zahnheilkunde – Prüfverfahren zur Biofilmbehandlung der wasserführenden Leitungen einer zahnärztlichen Behandlungseinheit
- Normenfamilie der DIN EN 60601:
Sicherheit und wesentlichen Leistungsmerkmale von medizinisch elektrischen Geräten
TecDoc Übersicht erstellen
Abschließend wurde die von IPP erstellte und die von der BS zur Verfügung gestellte Checkliste in ein „Medical Device File“ überführt, damit der Kunde die Vollständigkeit der TecDoc eigenständig prüfen kann. Zudem bietet der Medical Device File eine Orientierung (Inhaltsverzeichnis) der jeweiligen TecDoc, um den Ablageort der Dokumente nachvollziehen zu können.
Ergebnis
Ferner konnte der Kunde mit Unterstützung von IPP die vollständige Technische Dokumentation für ein Klasse IIa-Produkt als Pilotprojekt bei der Benannten Stelle einreichen und das MDR-Zertifikat für das QMS erlangen. Das Projekt zur MDR-Umstellung konnte erfolgreich abgeschlossen werden. IPP hat die Vorlagen sowie Technische Dokumentation an den Kunden übergeben, damit diese der Kunde eigenständig weiter pflegen kann.
Die Kommunikation und der Austausch mit der Benannten Stelle war sehr kooperativ und angenehm. Anfragen und Vorschläge wurden zeitnah und konstruktiv beantwortet. Schlussfolgernd lässt sich dazu sagen, dass ein aktives Zugehen der Hersteller auf die BS und ein regelmäßiger Austausch als förderlich für beide Seiten erachtet wurde.
Ausblick
Wie kannst Du ganz easy eine TecDoc nach MDR erstellen?
Verwende Easy13485 als Leitfaden für die Erstellung deiner Technischen Dokumentation. Easy13485 ist ein Qualitätsmanagement-System (QM-System), das Dich mit hilfreichen Tipps Schritt für Schritt zur TecDoc führt.
Weitere Informationen der Easy13485-Varianten sowie eine Demo-Version findest Du hier: https://ipp-nbg.de/iso-13485-qms/
Weitere interessante Artikel
https://ipp-nbg.de/ipp-empfehlung-inhalt-einer-technischen-dokumentation-nach-mdr-anhang-ii-iii/
https://ipp-nbg.de/technische-dokumentation-von-mdd-nach-mdr-umstellen/
https://ipp-nbg.de/ce-konformitaet-nach-mdr/
https://ipp-nbg.de/welche-benannte-stellen-sind-fuer-die-mdr-bereits-anerkannt/
https://ipp-nbg.de/mdr-uebergangsfrist-verlaengerung-loesung/
https://ipp-nbg.de/verlaengerung-der-uebergangsfristen-der-mdr/
https://ipp-nbg.de/ab-wann-gilt-die-udi-kennzeichnung/