Klinische Bewertungen gemäß MEDDEV 2.7/1 Revision 4
IPP Notizen aus der Praxis:
Die Revision 4 der Leitlinie MEDDEV 2.7/1 gilt seit 1. Juli 2016 und formuliert strengere Anforderungen. Bestehende klinische Bewertungen müssen gemäß dieser Revision aktualisiert werden.
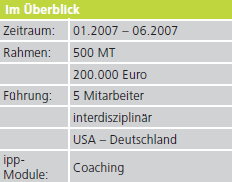
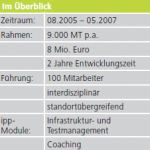
Aufgrund dieser gestiegenen Anforderungen entschied sich ein Kunde aus der Dentalmedizin dazu, die Aktualisierung von zwei Produktfamilien durch IPP zu verwirklichen.
- Beide Projekte sollen von IPP eigenständig durchgeführt werden
- Die klinischen Bewertungen sollen die Prüfungen der Benannten Stellen bestehen
- Beide Projekte sollen nach 2 Monaten abgeschlossen sein
Vorbereitung für die klinische Bewertung gemäß MEDDEV 2.7/1 Rev. 4:
- Aufstellung eines qualifizierten Autorenteams
- Gestaltung einer Vorlage
- Wissenserwerb über die zu bewertenden Produkte, der Zweckbestimmungen, sowie die technischen und medizinischen Hintergründe.
- Abstimmung und Überprüfung der benötigten Dokumente und Informationen
Umsetzung der klinischen Bewertung:
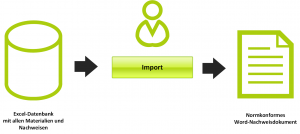
- Sammlung, Filterung und Bewertung von wissenschaftlicher Literatur
- Sammlung und Bewertung von klinischen Erfahrungen (u.a. aus Marktbeobachtung)
- Identifikation und Bewertung von Äquivalenzprodukten
- Aufbau einer Literaturbewertungsdatenbank
- Erstellung der finalen klinischen Bewertung gemäß MEDDEV 2.7/1 Rev. 4
Ergebnis:
Der Termin konnte trotz sehr enger Vorgabe und der erstmaligen Zusammenarbeit eingehalten werden.
Die klinischen Bewertungen gemäß Revision 4 der Leitlinie MEDDEV 2.7/1 wurden durch unser qualifiziertes Team zur Zufriedenheit des Kunden erfolgreich aktualisiert.