Projektmanagement für Großprojekte
Projektmanagement für Großprojekte
Ihre Ausgangslage:
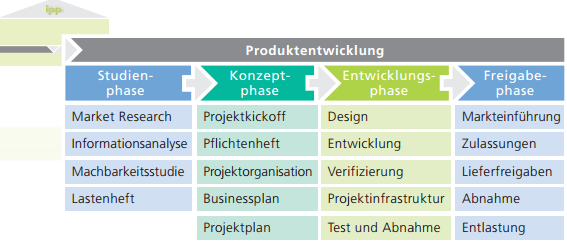
Bei großen, unternehmenskritischen Projekten werden alle verfügbaren Kapazitäten benötigt, um sich auf die Kernkompetenzen zu konzentrieren. Oft bleibt daher wenig Zeit, sich um die Rahmenkoordination zu kümmern. Termin- und Budgetdruck sind damit vorprogrammiert. Dieser Stress ist unnötig und lässt sich vermeiden.
Unsere Leistung:
Als externer Experte übernimmt IPP die operative Verantwortung für Ihr Projekt. Mit neutralem Blick und geschultem Auge sorgt der IPP-Experte für die termin- und budgetgerechte Umsetzung in allen Projektphasen. Angefangen bei der Erfassung und Analyse des Projektstatus, über umfassende Projektplanung und mitlaufendes Projektcontrolling.
Es brechen keine Meilensteine weg. Sie bringen Ihr Projekt gelassen und erfolgreich zu Ende. Als Interimsmanager begleiten wir Sie in der Regel mehrere Wochen bis Monate.
Nachhaltiger Erfolg für Ihr Projekt dank unserem Projektmanagement für Großprojekte
- Erhalten der Entwicklungskapazitäten
- Konzentration auf die Kernkompetenzen
- Transparenz für Ihre Entscheidungen
- Aufbau von Führungsnachwuchs durch begleitendes Coaching
- Konsequentes Einüben und damit nachhaltige Übertragung von praxiserprobten Management-Methoden auf das gesamte Team
- Projektabschluss in „time and budget“
Sie möchten hierzu weitere Informationen?
» Sprechen Sie uns an, wir erarbeiten Ihnen Ihr individuelles Angebot!