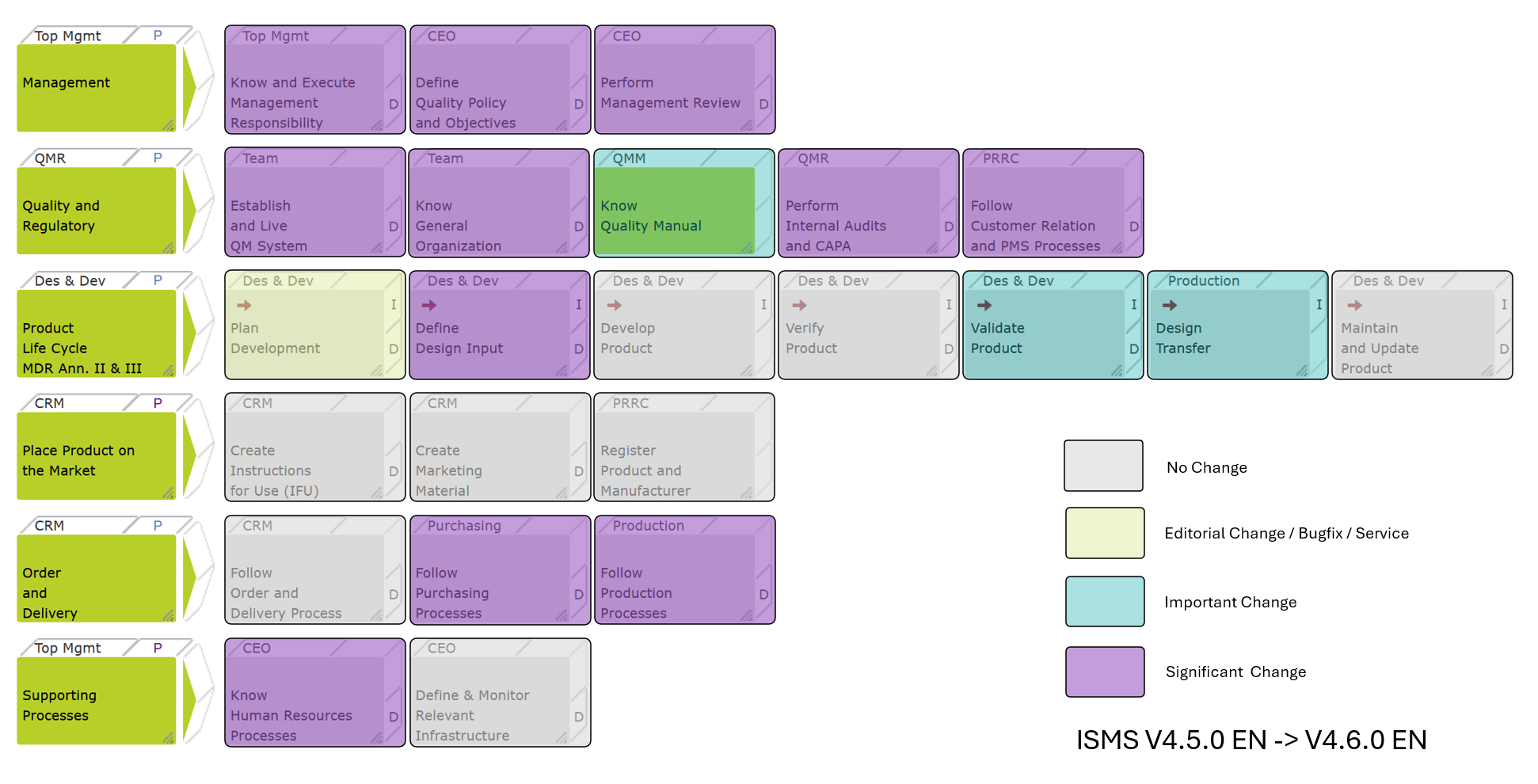
Easy13485 Update ISO IEC 27001 Release 4.6.0
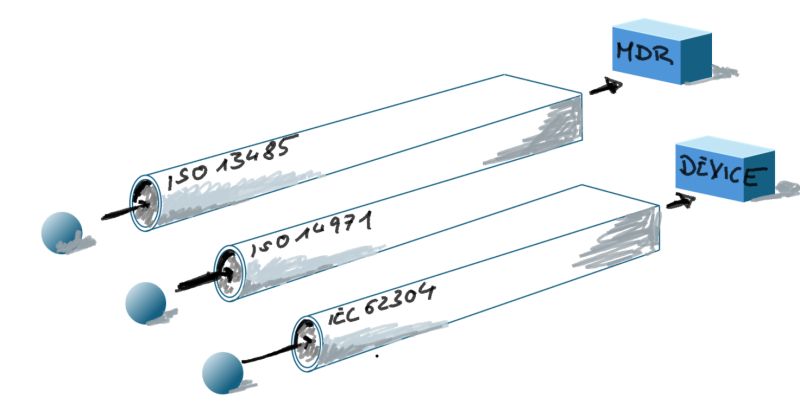
If you’re building SaMD, you can’t treat ISO 13485 (MDR) and ISO/IEC 27001 (ISMS) as separate projects anymore.
Release 4.6.0 integrates both into one lean, startup-operable QMS—without creating a second process landscape.